搜索
Daniel Cohen博士是世界著名的遗传学家和现代遗传学的先驱。他在法国Généthon实验室的工作对人类基因组图谱的发布做出了杰出的贡献。随后,他将大数据和自动化引入基因组学的研究,他和他的团队第一次证明可以用超快速计算来加快DNA样本的分析。

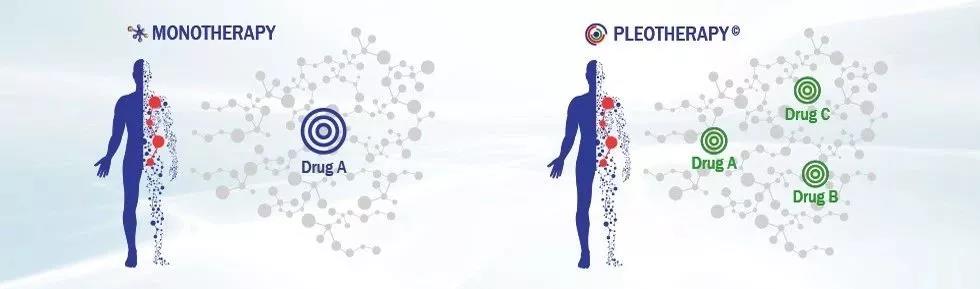
然而,在基因组学出现25年后,它给世界带来的革命性医疗突破却不如很多人的预期。如今,Cohen博士是一家名为Pharnext的法国医药公司的首席执行官。在他看来,基因多效性(pleiotropy)是让药物研发人员在攻克世界上的顽疾时一筹莫展的原因之一。“身体中任何蛋白都有很多功能,”他说:“就好比你作为一个人在社会中有很多功能。”
Cohen博士不但意识到基因多效性的重要性,而且他认为借助人工智能(AI),Pharnext和其它医药公司在不久的将来,能够利用它来开发创新药物组合,治疗多种疾病。
在Pharnext公司,Cohen博士和他的团队使用AI赋予了“老药新用”新的定义。他们可以从已有药物中发现创新药物组合,让组合疗法产生单个成分无法达到的治疗效果。他们的长远目标是利用机器学习来精简药物开发的过程,更为有效地构建药物研发管线。
与Pharnext公司拥有相同理念的公司还包括像谷歌和IBM这样的科技巨头,以及像Insilico Medicine,Recursion Pharmaceuticals,和BenevolentAI这样的初创公司。它们都深入投资AI工具,使用它们来分析上百万药物样本和患者数据,从中发现具有重要意义的规律。
而Pharnext公司10多年来应用AI解决医学问题的努力达到了一个重要的里程碑。去年10月,Pharnext开发的组合疗法PXT 303,在治疗腓骨肌萎缩症1A亚型(Charcot Marie Tooth disease,CMT1A)的3期临床试验中获得了积极结果。CMT1A是一种神经退行性疾病,致病的主要原因是患者携带的PMP22基因拷贝扩增,导致PMP22蛋白水平上升。这会导致保护神经的髓鞘损伤,神经也会逐渐死亡,肌肉出现萎缩。
3期临床试验结果表明PXT3003不但能够稳定CMT患者的病情,而且能够帮助细胞再生。患者的两项残疾检测指标出现了统计显著改善,而其它现有疗法只能延缓患者衰退的速度。基于这些结果,FDA今年2月授予了这一疗法快速通道资格,这款创新组合疗法有望在2020年上市。值得一提的是,这款在研新药已经在中国获得了优先审评资格,有望加速进入中国,为CMT1A患者造福。
这不仅是治疗CMT方面迈出重要一步,而且人工智能缩短药物开发路径的能力具有深远的影响。临床前检测和临床试验通常需要8-10年的时间,从头开始开发一款创新药可能为这一过程再加上7年以上的时间。而PXT3003的开发过程与之相比简洁了许多,AI帮助Pharnext选择了三款已有药物构成了新的组合:巴氯芬(baclofen)是一款肌肉松弛剂;纳曲酮(naltrexone)用来治疗阿片类药物依赖性;和山梨糖醇(sorbitol)通常用作泻药。因为这些药物已经被广泛使用,Pharnext公司可以跳过检验安全性的1期临床试验,并且消除了“从头开始”的药物开发阶段。
除了这一研发项目之外,Pharnext还将进行治疗阿兹海默病的2期临床试验和治疗肌萎缩性脊髓侧索硬化症(ALS)的2期临床试验,治疗这两种疾病的在研疗法也是利用AI从已有药物中构建的新组合疗法。如果这些试验获得成功,这种药物开发模式可能掀起“老药新用”的热潮。
在现代遗传学研究的初期,几乎没有人预见到疾病生物学蕴含的巨大复杂性。在人类基因组图谱最初完成时,人们以为获得了人体如何工作的一本说明书。根据基因组图谱,我们就能够找到解释特定疾病的那个基因,并且帮助发现治愈疾病的疗法。
一定程度上说,这些研究确实为我们带来了无上的瑰宝。例如遗传学家Nancy Wexler博士通过研究委内瑞拉亨廷顿病患者的家族史,最终发现了在单个基因上的突变能够预测一个人会不会得上这一疾病。
然而,科学家们很快发现基因与疾病之间的联系并不总是那么简单,像癌症和阿兹海默病这样的复杂疾病并不是因为一个基因的突变而产生。如今,Cohen博士和其它有识之士认为“化繁为简”的科研方式与药物开发的效率下降之间有着重要的联系。这种效率下降导致一款新疗法获得FDA批准的成功率只有10%,而且药物开发成本迅速上升。
近年来,科学家们开始在网络理论的帮助下开始解决生物复杂性的问题。网络理论的著名科学家,东北大学(Northeastern University)的Albert-László Barabási博士认为,疾病就像一个坏信号通过网络从基因传播到蛋白,再传播到细胞和组织,直到所有对网络的扰乱最终表现为我们通常熟悉的疾病症状。
复杂疾病是无数种影响的综合结果,因为基因多效性意味着任何蛋白可能在身体的不同部位发挥作用。像Pharnext这样的初创公司假设药物也可以具有多效性,它们可以与多种蛋白互动,在体内可以产生多种作用。想要发现能够解决复杂疾病的药物组合,我们必须把机器学习从海量数据中发现规律的重要能力,与疾病发生的结构化机制有机地结合在一起。
而这需要计算机科学家和生物学家之间合作关系的进化。新一代的机器学习手段能够吸收非常多的数据,并且发现超越相关性的洞见。然而,驾驭这些“深度学习”神经网络,让它们能够产生预测能力,仍然需要构筑一些精密的算法系统。
Pharnext和GNS公司的进展表明AI技术正在不断成长,它也带动了药理学的成长。人工智能发展的一个重要分界点,是拥有推断因果性的能力,并且用它来探索假想问题的答案。这些公司的计算机模型正在沿着这一方向进发。
在新药研发成本动辄上亿美元的今天,AI驱动的“老药新用”可能帮助医药企业从已经花费上千亿美元研制的药物中挖掘更多的价值。“你不一定需要设计新药,”Cohen断言:“我的感觉是只需要50种药构成不同的组合,就可以治疗所有疾病。”这将意味着我们需要改变“药物发现”的定义。
来源:生物探索







